Planeamiento Química 10° Eje Temático 3 tema 1, 2 y 3 (2025)
Instrucciones:
• Los bloques sombreados en color gris se pueden ocultar en la impresión final.
• Para ello haga clic sobre cada uno de los bloques que desea ocultar.
• Para encenderlo nuevamente, pulse el bloque otra vez.
• Solamente los bloques encendidos serán impresos.
• Pulse el botón «Imprimir» cuando se encuentre listo.
• Para un mayor aprovechamiento del espacio, recomendamos eliminar los márgenes al imprimir.
¿Cómo guardar PDF?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo, cambie el destino de la impresión:
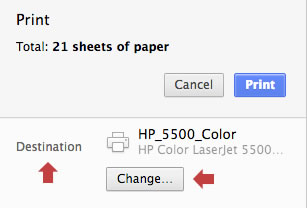
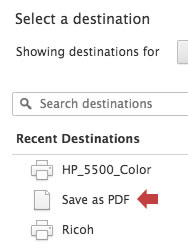
En las opciones, seleccione «Guardar como PDF»:
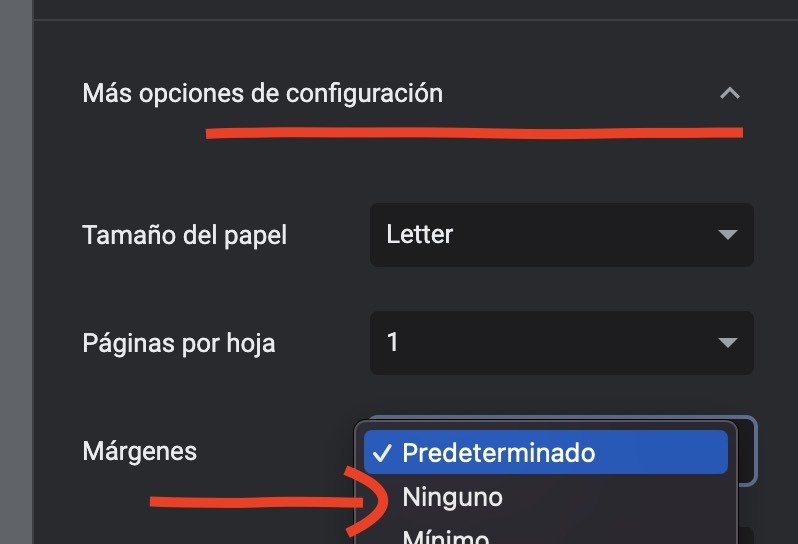
Para aprovechar todo el espacio de su hoja, recomendamos desactivar los márgenes:
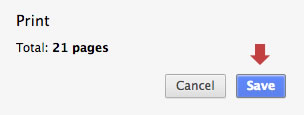
Por último pulse el botón «Guardar»:
¿Cómo imprimir en color?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo de la impresión siga las siguientes instrucciones:
Si desea imprimir el planeamiento a color, asegúrese de activar la opción «Color»:
En la sección «Más configuraciones»:
Active la opción «Gráficos de fondo»:

Finalmente pulse el botón «Imprimir»:
Curso lectivo: 2025
Periodicidad:
Competencias generales
Ciudadanía responsable y solidaria ( )
Para la vida ( )
Para la empleabilidad digna ( x )
Tema 1: Valores estequiométricos
Criterio de evaluación
Resolver mediante conversiones, el concepto de los valores estequiométricos como, por ejemplo: el mol, átomos, moléculas, número de partículas o el número de Avogadro.
Estrategias de mediación
Focalización
La persona docente inicia la clase solicitando al estudiantado que se organice en grupos de tres personas. Cada grupo debe analizar y responder por escrito las siguientes preguntas:
• ¿Cómo puedo determinar la cantidad necesaria de sustancias para que ocurra una reacción química?
• ¿Qué acciones tomaría si no se produce la reacción esperada?
• ¿Qué cálculos debería realizar previamente para asegurar resultados exitosos?
Las respuestas se comparten en plenaria y la persona docente orienta la discusión con preguntas como: “¿Por qué es importante realizar cálculos antes de una reacción?” o “¿Qué consecuencias puede tener un error en las cantidades utilizadas?”
La persona docente solicita al estudiantado que se dirija a la biblioteca de la institución y, en equipos, investigue y consulte fuentes confiables para responder las siguientes preguntas:
• ¿Qué es la estequiometría?
• ¿Cómo se aplica la estequiometría en las reacciones químicas?
• ¿Quién estableció el concepto de estequiometría?
• ¿Qué buscaba explicar con este término?
Posteriormente, el estudiantado regresa al aula y anota las ideas principales que la docente refuerza mediante una explicación estructurada. La persona docente orienta la comprensión con preguntas como: “¿Por qué es importante la estequiometría en el estudio de la química?” o “¿Cómo se relaciona con la predicción de productos en una reacción?
En grupos, el estudiantado analiza la pregunta: ¿Qué significa un mol en química?”y la compara con unidades cotidianas como docena, decena o centena. Cada grupo elabora un ejemplo visual con objetos de uso común que representen estas cantidades. Los ejemplos se comparten en plenaria. La persona docente orienta el diálogo con preguntas como: ¿Por qué usamos unidades como el mol en química? o ¿Qué ventaja tiene hablar de moles en lugar de partículas?
En parejas, el estudiantado organiza tarjetas con los conceptos: átomo, molécula, mol, número de Avogadro, gramo y partícula. Cada pareja construye un mapa conceptual que relacione los términos. Se realiza una caminata por el aula para observar los mapas y la docente guía la discusión con preguntas como: ¿Qué relaciones son más claras? o ¿Dónde hay dudas o confusiones?
En pequeños grupos, el estudiantado escribe una lista de situaciones de la vida cotidiana donde se requieren conteos masivos (paquetes, productos, sustancias). Luego responde: “¿Qué pasaría si tuviéramos que contar cada unidad sin una medida estándar?” La actividad finaliza con una reflexión compartida y la docente guía el cierre con preguntas como: ¿Qué relación hay entre estas situaciones y el uso del mol? o ¿Cómo simplifica el mol los cálculos químicos?
En equipos, el estudiantado observa la ecuación química presentada en la página 202 del libro y analiza el cuadro que desglosa los valores en moles y gramos de cada sustancia involucrada. A partir de esta información, cada equipo responde preguntas.
Una vez completadas las respuestas, cada equipo comparte sus ideas en una puesta en común guiada por la persona docente.
Durante la socialización de ideas, la persona docente puede orientar la reflexión con las siguientes preguntas:
• ¿Por qué es necesario conocer la cantidad de moles y gramos en una reacción química antes de llevarla a cabo?
• ¿Qué errores podrían surgir si se ignoran los valores estequiométricos al preparar una reacción?
• ¿De qué manera nos ayuda la estequiometría a predecir la cantidad de productos que se van a formar?
Exploración
n equipos, el estudiantado revisa el contenido de las páginas 203 a 206 del libro de texto, centrado en el tema de la estequiometría. Durante la lectura, subrayan los conceptos clave relacionados con la cantidad de sustancia, masa molar, relaciones molares en una ecuación química balanceada, y el procedimiento para calcular la masa o los moles de los reactivos y productos.
Con la información obtenida, cada equipo organiza un lapbook temático que contenga:
• Definición y utilidad de la estequiometría.
• Relación entre masa, moles y número de partículas.
• Pasos para resolver un problema estequiométrico.
• Un ejemplo ilustrado de conversión entre gramos y moles.
Posteriormente, los equipos socializan sus lapbooks en pequeños grupos, con la guía de la persona docente.
En parejas, el estudiantado utiliza una simulación virtual (como PhET ) para observar cómo varían las cantidades de partículas, masa y moles al modificar los parámetros. Cada bina responde una guía de análisis que luego se discute en plenaria. La persona docente formula preguntas como: ¿Qué patrones observaron? o ¿Cómo les ayuda la simulación a visualizar los conceptos abstractos?
En pequeños grupos, el estudiantado construye una tabla de equivalencias que relacione: 1 mol = número de Avogadro de partículas = masa molar = volumen de gas (en condiciones normales). Cada grupo presenta su tabla con un ejemplo numérico concreto. La docente guía la retroalimentación con preguntas como: ¿Qué utilidad tiene esta tabla? o ¿Qué errores deben evitarse al usarla?
Reflexión y contrastación
En grupos, el estudiantado resuelve un problema con más de una estrategia posible (por ejemplo: convertir gramos a moléculas utilizando directamente la masa molar o pasando primero por moles) página 207 del libro. Cada grupo explica cuál estrategia prefirió y por qué. La docente modera la discusión con preguntas como: ¿Qué ruta fue más clara? o ¿En qué casos podría ser útil cada método?
En equipos, el estudiantado analiza un problema estequiométrico planteado por la persona docente (por ejemplo: “¿Cuántos átomos hay en 10 g de carbono?”). A partir del análisis, cada equipo menciona oralmente los aspectos generales que deben considerarse para resolverlo, como el uso del mol, la masa molar, el número de Avogadro, y la relación entre gramos, moles y número de partículas.
Luego, cada integrante redacta un resumen individual donde explique con sus propias palabras los pasos necesarios para hacer conversiones en este tipo de problemas y el significado de cada valor estequiométrico involucrado (mol, átomo, molécula, partícula, número de Avogadro).
La persona docente orienta la socialización de ideas con preguntas como:
• ¿Qué relación existe entre la masa de una sustancia y la cantidad de partículas que contiene?
• ¿Por qué es útil el número de Avogadro en los cálculos químicos?
• ¿Qué dificultades encontraron al tratar de explicar el concepto de mol en palabras propias?
En parejas, el estudiantado redacta una explicación escrita que responda a la pregunta: “¿Por qué el mol es clave para entender la cantidad de materia?” Deben usar al menos los términos: átomo, molécula, masa molar y número de Avogadro. Las respuestas se intercambian entre compañeros para retroalimentación. La docente guía la revisión con preguntas como: “¿Qué términos faltan?” o “¿Qué parte necesita más claridad?”
En equipos, el estudiantado elabora una infografía titulada: “Del mol al mundo real”. Deben incluir una situación de la vida cotidiana, una conversión resuelta y una analogía. Las infografías se presentan en una exposición. La persona docente promueve la reflexión con preguntas como: “¿Cómo conecta tu infografía con lo aprendido?” o “¿Qué fue lo más difícil de representar gráficamente?”
En pequeños grupos, el estudiantado discute la afirmación: “La química sería imposible sin el mol”. Cada grupo argumenta a favor o en contra, utilizando ejemplos de conversiones. Las conclusiones se comparten en una mesa redonda. La persona docente orienta el cierre con preguntas como: “¿Qué evidencia respalda su posición?” o “¿Qué cambiarías si repitieras el análisis?”
Aplicación
En grupos, el estudiantado resuelve un caso contextualizado: “Una empresa embotella oxígeno para buceo. Si cada tanque contiene 10 moles de O₂, ¿cuántas moléculas se embotellan por día si se llenan 150 tanques?” Deben mostrar su razonamiento en un cartel y presentarlo al grupo. La docente orienta la retroalimentación con preguntas como: “¿Qué conversiones aplicaron?” o “¿Cómo pueden verificar sus cálculos?”
En equipos, el estudiantado diseña un juego de mesa o trivia que incluya preguntas de conversión entre gramos, moles y partículas. El juego debe incluir instrucciones claras y ejemplos resueltos. Los juegos se prueban entre grupos. La docente guía la evaluación con preguntas como: “¿Qué tan claro fue el juego para tus compañeros?” o “¿Qué concepto fue más difícil de convertir en pregunta?”
En parejas, el estudiantado graba un video corto explicando cómo resolver una conversión (por ejemplo: de gramos a moléculas), usando una analogía visual. Los videos se comparten en la plataforma del aula y se valoran entre pares. La docente orienta la retroalimentación con preguntas como: “¿Qué parte fue más clara?” o “¿Qué se podría mejorar para la próxima explicación?”
En forma individual, el estudiantado resuelve una evaluación escrita con ejercicios de conversión entre moles, gramos, partículas y moléculas, incluyendo problemas contextualizados. Luego, responde una pregunta abierta: “¿Para qué sirve aprender sobre el mol en la vida cotidiana?” La docente recoge los resultados para retroalimentar y reforzar aprendizajes clave.
Indicadores
Identifica mediante conversiones, el concepto de los valores estequiométricos como, por ejemplo: el mol, átomos, moléculas, número de partículas o el número de Avogadro, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Destaca aspectos relevantes de los pasos necesarios para la solución de un problema mediante cálculos matemáticos concretos las condiciones de interacción de los moles, gramos, átomos y moléculas, así como el número de partículas involucradas en una reacción química, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Anota los pasos básicos para solucionar un problema. los pasos necesarios para la solución de un problema mediante cálculos matemáticos concretos las condiciones de interacción de los moles, gramos, átomos y moléculas, así como el número de partículas involucradas en una reacción química, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Describe de manera general mediante conversiones, el concepto de los valores estequiométricos como, por ejemplo: el mol, átomos, moléculas, número de partículas o el número de Avogadro en el problema que se desea resolver, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Resalta aspectos específicos sobre las conversiones, el concepto de los valores estequiométricos como, por ejemplo: el mol, átomos, moléculas, número de partículas o el número de Avogadro en el problema que se desea resolver, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Menciona aspectos generales sobre las conversiones, el concepto de los valores estequiométricos como, por ejemplo: el mol, átomos, moléculas, número de partículas o el número de Avogadro .en el problema que se desea resolver, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Tema 2: Cálculos matemáticos concretos
Criterio de evaluación
Demostrar mediante cálculos matemáticos concretos las condiciones de interacción de los moles, gramos, átomos y moléculas, así como el número de partículas involucradas en una reacción química.
Estrategias de mediación
Focalización
La persona docente proyecta una imagen de piedras o piezas de oro en su estado natural (p. 208) y solicita al estudiantado que observe detenidamente. A partir de la imagen, cada estudiante responde por escrito las siguientes preguntas:
• ¿Qué elemento químico creen que se representa en la imagen?
• ¿Cuántos moles representa la cantidad mostrada, si tuvieras 197 gramos del elemento?
• ¿Cuántos átomos contiene un mol de ese elemento?
Posteriormente, se realiza una puesta en común guiada por la docente, quien fomenta el análisis con preguntas como: “¿Cómo se relaciona la masa con el número de moles?” o “¿Por qué todos los elementos tienen el mismo número de partículas por mol, aunque tengan diferente masa
En parejas, el estudiantado intenta calcular de forma autónoma las proporciones atómicas del compuesto ácido fosfórico (H₃PO₄). Para ello, cada pareja anota en su cuaderno lo siguiente:
• Número de unidades fórmulares del compuesto.
• Cantidad de átomos de hidrógeno presentes.
• Cantidad de átomos de fósforo presentes.
• Cantidad de átomos de oxígeno presentes.
Una vez completado el ejercicio, la persona docente guía al grupo en la explicación detallada del procedimiento correcto, aclarando cómo se determinan las proporciones atómicas a partir de la fórmula química.
La docente orienta la comprensión colectiva con preguntas como: ¿Qué información nos brinda la fórmula H₃PO₄?, ¿Por qué se considera una unidad formulare? o ¿Cómo se extrapolan estos datos a un mol del compuesto?”
En grupos de tres, el estudiantado confecciona una infografía con las unidades químicas clave: mol, gramos, moléculas, átomos y número de Avogadro. Se realiza una puesta en común. La docente guía la reflexión con preguntas como: “¿Qué unidad sirve como puente para todas las demás?” o “¿Cuál se refiere a una cantidad constante de partículas?”
La persona docente presenta una analogía visual del mol como una “docena química” y plantea: “¿Qué pasaría si quisiéramos contar moléculas en lugar de huevos o personas?” El estudiantado responde en parejas, representando con dibujos el significado del número de Avogadro. Las representaciones se socializan en plenaria.
Exploración
En pequeños grupos, el estudiantado comparte experiencias previas con cálculos en química. Se les pide que expliquen con sus palabras: ¿Qué es un mol? ¿Qué es una molécula? ¿Qué es un átomo? ¿Qué significa convertir gramos a moles? Las respuestas se recopilan y contrastan con definiciones científicas.
En equipos, el estudiantado revisa el contenido de las páginas 209 y 211 del libro de texto, donde se explican las relaciones estequiométricas a partir de ecuaciones químicas balanceadas y se detallan los procedimientos para realizar cálculos estequiométricos. A partir de la lectura, cada equipo elige una de las siguientes formas de organización del conocimiento:
• Elaborar un lapbook que contenga los pasos del procedimiento estequiométrico y ejemplos ilustrativos.
Cada grupo presenta su producto visual al resto de la clase. Durante la puesta en común, la persona docente orienta el análisis con preguntas como:
• ¿Cuál es la importancia de balancear la ecuación antes de aplicar las relaciones estequiométricas?
• ¿Qué rol juegan los coeficientes estequiométricos en los cálculos con moles o gramos?
• ¿Qué parte del procedimiento es más fácil de confundir y cómo podemos evitar errores?
Al finalizar, la docente realiza un repaso colectivo del procedimiento general utilizando una representación visual en el pizarrón, reforzando las conexiones clave entre ecuación balanceada, relaciones mol-mol, y conversiones con masa o número de partículas.
En estaciones de trabajo, cada grupo resuelve un tipo específico de conversión (por ejemplo, Estación 1: gramos ↔ moles, Estación 2: moles ↔ partículas, Estación 3: gramos ↔ partículas). Al rotar, cada grupo debe comparar sus respuestas con la clave y corregir si es necesario.
Reflexión y contrastación
En equipos, el estudiantado explica con sus propias palabras, por escrito, cómo resolver un problema estequiométrico. Luego intercambian sus explicaciones con otro grupo, quien debe identificar fortalezas y debilidades en el razonamiento. La docente orienta el diálogo con preguntas como: ¿Está clara la relación entre unidades? o ¿Qué paso falta o se repite?
Cada grupo resuelve un problema con dos rutas posibles (por ejemplo: convertir de gramos a moléculas directamente o pasando por moles). Luego, presentan y comparan sus soluciones. La persona docente fomenta la reflexión con preguntas como: ¿Qué ruta fue más eficiente? o ¿Ambas son válidas?
Ejemplo de problemas:
1. En una muestra hay 36 gramos de agua (H₂O). ¿Cuántas moléculas de agua hay en esa cantidad?
Ruta 1 (directa):
a. Calcular moles a partir de gramos utilizando la masa molar del agua (18 g/mol).
b. Convertir moles a número de moléculas utilizando el número de Avogadro (6.022 × 10²³ moléculas/mol).
Ruta 2 (extendida):
a. Calcular moles desde gramos (igual que en Ruta 1).
b. Determinar cuántas moléculas hay en 1 mol, y luego multiplicar por los moles obtenidos.
Opcional: incluir paso intermedio de átomos si el grupo desea profundizar.
2. ¿Cuántos átomos de oxígeno hay en 88 gramos de dióxido de carbono (CO₂)?
Ruta 1 (directa):
a. Calcular moles de CO₂ usando su masa molar (44 g/mol).
b. Convertir moles de CO₂ a moléculas de CO₂.
c. Multiplicar por 2 (ya que cada molécula de CO₂ contiene 2 átomos de oxígeno).
Ruta 2 (por pasos):
Gramos → moles de CO₂.
a. Moles de CO₂ → número de moléculas (usando el número de Avogadro).
b. Moléculas de CO₂ → átomos de oxígeno (multiplicando por 2).
En plenaria, la clase analiza un error común al hacer conversiones (por ejemplo, usar masa molar incorrecta o confundir moléculas con átomos). Cada grupo propone una estrategia para evitar el error. Se construye colectivamente una lista de buenas prácticas para resolver problemas estequiométricos.
Aplicación
En equipos, el estudiantado resuelve un caso real: “Una empresa quiere saber cuántos gramos de oxígeno necesita para reaccionar con 10 moles de hidrógeno. ¿Cuántas moléculas de agua se producen?” Cada equipo expone sus resultados y justifica el procedimiento utilizado.
En parejas, el estudiantado elabora un problema original contextualizado que implique conversiones entre moles, gramos y partículas. Luego intercambian los problemas con otra pareja y los resuelven. La docente guía la retroalimentación.
En forma individual, el estudiantado elabora una infografía o cartel explicativo titulado: “¿Cómo se relacionan los gramos, los moles y las moléculas en una reacción química?” con ejemplos numéricos. Se organiza una galería didáctica para compartir los trabajos.
Indicadores
Describe mediante cálculos matemáticos concretos las condiciones de interacción de los moles, gramos, átomos y moléculas, así como el número de partículas involucradas en una reacción química, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Resalta aspectos específicos mediante cálculos matemáticos concretos las condiciones de interacción de los moles, gramos, átomos y moléculas, así como el número de partículas involucradas en una reacción química, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Menciona mediante cálculos matemáticos concretos las condiciones de interacción de los moles, gramos, átomos y moléculas, así como el número de partículas involucradas en una reacción química, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Establece los pasos necesarios para la solución de un problema mediante cálculos matemáticos concretos las condiciones de interacción de los moles, gramos, átomos y moléculas, así como el número de partículas involucradas en una reacción química, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Destaca aspectos relevantes de los pasos necesarios para la solución de un problema mediante cálculos matemáticos concretos las condiciones de interacción de los moles, gramos, átomos y moléculas, así como el número de partículas involucradas en una reacción química, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Anota los pasos básicos para solucionar un problema. los pasos necesarios para la solución de un problema mediante cálculos matemáticos concretos las condiciones de interacción de los moles, gramos, átomos y moléculas, así como el número de partículas involucradas en una reacción química, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Tema 3: Minimizando el impacto humano sobre la integridad del planeta Tierra y el universo
Criterio de evaluación
Practicar acciones que minimicen el impacto humano y que contribuyan a la integridad del Planeta Tierra y su relación con el Universo.
Estrategias de mediación
Focalización
En parejas, el estudiantado realiza una lluvia de ideas sobre sustancias químicas que se usan cotidianamente (aerosoles, plásticos, combustibles, detergentes). Luego clasifica cuáles podrían tener efectos negativos sobre el ambiente. La docente promueve el análisis con preguntas como: “¿Qué reacciones o compuestos son responsables de esos efectos?”
La persona docente proyecta una imagen de la capa de ozono y plantea la pregunta: “¿Qué relación puede tener el uso de ciertos productos químicos con el deterioro de esta capa?” En grupos, el estudiantado formula hipótesis. Las respuestas se contrastan en plenaria.
En grupos, el estudiantado completa un organizador gráfico con el título “Química en mi entorno”, en el que identifica sustancias químicas presentes en productos domésticos, escolares y del transporte. Discuten posibles impactos de su uso desmedido.
La persona docente inicia la clase presentando al estudiantado un fragmento seleccionado de La Carta de la Tierra, centrado en los principios de respeto y cuidado por la comunidad de la vida y la integridad ecológica. El documento puede obtenerse desde el enlace sugerido en la sección de recursos digitales del libro de texto.
Luego, en forma individual, el estudiantado reflexiona y responde por escrito las siguientes preguntas:
• Si tuvieran la oportunidad de revertir un daño ambiental causado por la acción humana, ¿cuál elegirías y por qué?
• ¿Creen que el planeta está en “media vida” o en una etapa crítica? ¿Qué evidencia científica, desde la química, apoya tu opinión?
La persona docente orienta una conversación guiada en plenaria a partir de las respuestas, fomentando la conexión entre el pensamiento ambiental y los principios de la química, formulando preguntas como:
• ¿Qué sustancias químicas están implicadas en los daños ambientales que mencionaron?
• ¿Qué tipo de reacciones químicas podrían estar generando desequilibrios en los ciclos naturales del planeta?
• ¿Cómo puede la química contribuir a restaurar o evitar el deterioro de la Tierra?
Exploración
En equipos, el estudiantado consulta fuentes confiables (libro, internet, documentos institucionales) sobre compuestos químicos que contribuyen al cambio climático, la lluvia ácida o la destrucción de la capa de ozono. Cada equipo construye una ficha informativa por sustancia (nombre, fórmula, uso común, efecto ambiental).
En binas, el estudiantado analiza el ciclo de vida de un producto químico (como el plástico o un fertilizante) y determina en qué etapas ocurre mayor impacto ambiental. Lo representan en una línea de tiempo y lo exponen ante la clase.
En pequeños grupos, el estudiantado clasifica una lista de prácticas humanas según su impacto en el medio ambiente (alto, medio, bajo) y justifica su clasificación desde la química (tipo de reacciones, residuos generados, liberación de gases).
La docente organiza una galería didáctica con ejemplos de tecnologías químicas sostenibles (bioplásticos, energías limpias, catalizadores verdes). Cada grupo investiga un caso y lo representa en una infografía. Se presentan en plenaria.
Reflexión y contrastación
En equipos, el estudiantado analiza el dilema: “¿Debería prohibirse el uso de productos que afectan el ambiente aunque sean económicamente accesibles?” y argumenta desde el punto de vista químico, ambiental y social. La discusión se realiza en formato de mesa redonda.
En parejas, el estudiantado compara dos productos con la misma función (por ejemplo: bolsas plásticas vs. bolsas biodegradables) e investiga los compuestos químicos involucrados y su impacto ambiental. Presentan sus hallazgos en un cuadro comparativo.
Cada estudiante redacta un párrafo en el que relacione las acciones humanas, el uso de productos químicos y su impacto en el equilibrio de los ciclos biogeoquímicos. La docente retroalimenta con preguntas como: ¿Qué rol tienen las reacciones químicas en estos impactos?
En equipos, el estudiantado revisa el contenido de la página 217 del libro de texto, que presenta acciones orientadas a minimizar el impacto humano sobre el ambiente y a contribuir con la integridad del planeta desde una perspectiva científica y sostenible.
A partir de la lectura, cada equipo elige tres acciones destacadas y analiza cómo estas se relacionan con procesos químicos o con el uso responsable de sustancias en la vida cotidiana. Luego, elaboran un recurso visual a su elección (infografía, cartel informativo o presentación digital) que incluya:
• La descripción de cada acción.
• La relación de esa acción con principios de la química (por ejemplo: reducción de residuos químicos, sustitución de compuestos tóxicos, uso de materiales biodegradables).
• Una propuesta concreta para aplicar esa acción en su comunidad o centro educativo.
Al finalizar, los grupos socializan sus trabajos en una galería didáctica. La persona docente orienta la retroalimentación con preguntas como:
En equipos, el estudiantado revisa el contenido de la página 217 del libro de texto, que presenta acciones orientadas a minimizar el impacto humano sobre el ambiente y a contribuir con la integridad del planeta desde una perspectiva científica y sostenible.
A partir de la lectura, cada equipo elige tres acciones destacadas y analiza cómo estas se relacionan con procesos químicos o con el uso responsable de sustancias en la vida cotidiana. Luego, elaboran un recurso visual a su elección (infografía, cartel informativo o presentación digital) que incluya:
– La descripción de cada acción.
– La relación de esa acción con principios de la química (por ejemplo: reducción de residuos químicos, sustitución de compuestos tóxicos, uso de materiales biodegradables).
– Una propuesta concreta para aplicar esa acción en su comunidad o centro educativo.
Al finalizar, los grupos socializan sus trabajos en una galería didáctica. La persona docente orienta la retroalimentación con preguntas como:
• ¿Qué procesos químicos están implicados en las acciones seleccionadas?
• ¿Qué beneficios ecológicos tienen estas acciones desde el punto de vista molecular o de la composición de los materiales?
• ¿Cuál de estas propuestas sería más viable y efectiva en su entorno cercano?”¿Qué procesos químicos están implicados en las acciones seleccionadas?
• ¿Qué beneficios ecológicos tienen estas acciones desde el punto de vista molecular o de la composición de los materiales?
• ¿Cuál de estas propuestas sería más viable y efectiva en su entorno cercano?
Aplicación
En grupos, el estudiantado simula una reunión del comité ambiental estudiantil en la que debe decidir qué prácticas químicas deben eliminarse, regularse o promoverse en la institución. Deben justificar sus decisiones con base en los principios de la química verde.
Cada estudiante diseña un cartel informativo con recomendaciones químicamente fundamentadas para disminuir el impacto ambiental en casa o en la institución (ej.: evitar cloro, usar vinagre y bicarbonato, elegir productos biodegradables). Los carteles se colocan en zonas visibles.
En equipos, el estudiantado elabora una propuesta de acción local para minimizar el impacto químico en su comunidad (ej.: campaña de reciclaje químico, eliminación segura de residuos domésticos, sustitución de productos tóxicos). Las propuestas se presentan en un mural colectivo.
Indicadores
Plantea acciones que minimicen el impacto humano y que contribuyan a la integridad del Planeta Tierra y su relación con el Universo, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Alude acciones que minimicen el impacto humano y que contribuyan a la integridad del Planeta Tierra y su relación con el Universo, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Menciona acciones que minimicen el impacto humano y que contribuyan a la integridad del Planeta Tierra y su relación con el Universo, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Determina la eficacia de las diversas formas de resolver un problema que minimicen el impacto humano y que contribuyan a la integridad del Planeta Tierra y su relación con el Universo, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Destaca aspectos relevantes de las diversas formas de resolver un problema que minimicen el impacto humano y que contribuyan a la integridad del Planeta Tierra y su relación con el Universo, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Indica las diversas formas de resolver un problema que minimicen el impacto humano y que contribuyan a la integridad del Planeta Tierra y su relación con el Universo, mediante actividades didácticas orales y escritas asignadas por la persona docente.