Planeamiento Química 10° Eje temático 1 temas 10 y 11 (2025)
Instrucciones:
• Los bloques sombreados en color gris se pueden ocultar en la impresión final.
• Para ello haga clic sobre cada uno de los bloques que desea ocultar.
• Para encenderlo nuevamente, pulse el bloque otra vez.
• Solamente los bloques encendidos serán impresos.
• Pulse el botón «Imprimir» cuando se encuentre listo.
• Para un mayor aprovechamiento del espacio, recomendamos eliminar los márgenes al imprimir.
¿Cómo guardar PDF?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo, cambie el destino de la impresión:
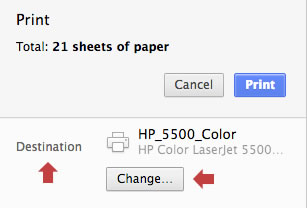
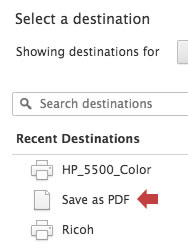
En las opciones, seleccione «Guardar como PDF»:
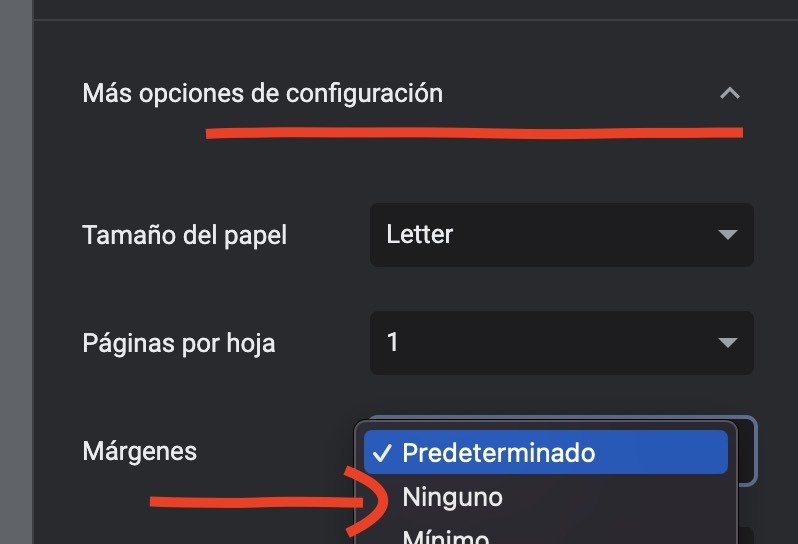
Para aprovechar todo el espacio de su hoja, recomendamos desactivar los márgenes:
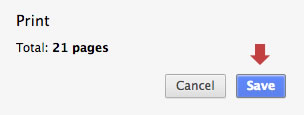
Por último pulse el botón «Guardar»:
¿Cómo imprimir en color?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo de la impresión siga las siguientes instrucciones:
Si desea imprimir el planeamiento a color, asegúrese de activar la opción «Color»:
En la sección «Más configuraciones»:
Active la opción «Gráficos de fondo»:

Finalmente pulse el botón «Imprimir»:
Curso lectivo: 2025
Periodicidad:
Competencias generales
Ciudadanía responsable y solidaria ( X )
Para la vida ( )
Para la empleabilidad digna ( )
Tema: El átomo, partículas subatómicas, número atómico, número másico, isótopos, masa atómica promedio y El átomo y sus partes, las diferentes características que presentan los elementos que nos rodean.
Criterio de evaluación
Recordar las nociones básicas y la teoría relacionada con el átomo, partículas subatómicas, número atómico, número másico, isótopos, masa atómica promedio.
Distinguir de acuerdo con el concepto de átomo y sus partes, las diferentes características que presentan los elementos que nos rodean.
Estrategias de mediación
Focalización
El docente les dibuja en la pizarra la estructura comúnmente vista del átomo, y les solicita ayuda para poder completarla con los protones, electrones, neutrones y el núcleo y con ello comprobar no solamente el conocimiento previo sino además generar preguntas y análisis de la estructura del átomo y sus partes.
Posteriormente con papel periódico, cartulina o material reciclado, elaboran con su propio conocimiento, ideas de libros de texto, apoyo de la web, una exposición donde explique la siguiente interrogante:
¿De cuántos átomos creo que está formado el ser humano?
El docente plantea la pregunta: “Si todo está hecho de átomos, ¿por qué no podemos verlos?” Los estudiantes responden con hipótesis en una lluvia de ideas.
En la pizarra, se anotan términos clave como «átomo», «masa», «elemento» e «isótopo». Los estudiantes explican lo que creen que significa cada uno antes de profundizar en el tema.
Los estudiantes realizan la actividad de entrada de tema de la página 85 del libro para iniciar la lluvia de ideas sobre el átomo y sus partes.
Exploración
Los estudiantes revisan el contenido de la página 76 con el objetivo de definir el átomo y sus partes y analizar la teoría de Dalton. Los estudiantes organizan la información en una infografía. Comentan el resultado con los compañeros.
Los estudiantes elaboran un modelo tridimensional del átomo con plastilina o materiales reciclados.
La docente inicia la explicación de los siguientes conceptos: átomo, partículas subatómicas, número atómico, número másico, isótopos, masa atómica promedio. Y los estudiantes realizan anotaciones y participan de forma activa en la clase. Luego, los estudiantes comparan sus apuntes con el contenido del libro de las páginas 78, 79 y 80 del libro. Los estudiantes amplían y corrigen sus apuntes,
Los estudiantes con la guía del docente realizan una lectura comentada del texto composición de un átomo, de acuerdo a las observaciones y pausas del docente van tomando apuntes en sus cuadernos.
Cada estudiante elabora un mapa mental que incluya:
• Protones, neutrones y electrones con sus características.
• Número atómico y número másico.
• Ubicación de las partículas dentro del átomo.
• Ejemplo de un elemento químico con su configuración atómica.
Los estudiantes exponen su trabajo y comparan los mapas mentales para identificar diferencias y similitudes en su organización.
Reflexión y contrastación
Los estudiantes realizan la Actividad de la página 77 del libro. Comparten los resultados con los compañeros.
Los estudiantes en parejas realizan las actividades de las páginas 80 hasta la 82. Comparten el resultado con los compañeros.
A partir de la lectura de las páginas 86 hasta la 88 el docente les asigna a cada estudiante el rol de protón, electrón o neutrón.
Cada uno debe explicar sus características y cómo interactúan dentro del átomo.
El docente les plantea diferentes situaciones (ejemplo: “Si un electrón se pierde, ¿qué ocurre con la carga del átomo?”) y deben responder desde el punto de vista de su partícula.
Luego, se forma un «átomo humano» con los estudiantes organizados como núcleo y nube electrónica.
Los estudiantes usan una simulación interactiva en línea (como la de PhET de la Universidad de Colorado) para construir diferentes átomos y visualizar la disposición de sus partículas.
Exploran cómo varían los átomos al agregar o quitar protones, neutrones y electrones.
Responden preguntas sobre cómo se afectan la carga, la masa atómica y la identidad del elemento cuando se modifican sus partículas.
Los estudiantes realizan las Actividades de las páginas 89 hasta la 91, Comentan las respuestas con los compañeros.
Aplicación
Los estudiantes resuelven la Evaluación de la página 83 y 84. Revisan sus resultados con los compañeros.
Los estudiantes resuelven el imprimible # 11 y comentan el resultado con los compañeros.
Los estudiantes distribuidos en subgrupos construyen un modelo tridimensional de un átomo utilizando plastilina o materiales reciclados.
Deben representar protones, neutrones y electrones, indicando su carga y ubicación.
Presentan su modelo a la clase explicando la función de cada partícula.
Se comparan diferentes átomos, destacando el número de protones, neutrones y electrones en cada uno.
El docente les presenta la siguiente pregunta: «¿Qué pasaría si un átomo pierde un electrón? ¿Y si gana un protón?»
Los estudiantes crean un diagrama de Ishikawa (causa-efecto) donde analizan las consecuencias de alterar el número de partículas en un átomo.
Relacionan estos cambios con la formación de iones, cambios en la carga y estabilidad del átomo.
Comparten sus diagramas y discuten las implicaciones en la química y la vida cotidiana.
El docente plantea los siguientes ejercicios a los estudiantes:
1. Identifica el elemento basándote en las pistas.
Pistas:
• Tiene 11 protones en su núcleo.
• Su número másico es aproximadamente 23.
• Se encuentra en la primera columna de la tabla periódica y es un metal.
¿Qué elemento es?
Respuesta: Sodio (Na).
2. Completa la secuencia de elementos según su número atómico.
Secuencia dada:
H (1), Li (3), B (5), ? , F (9), Na (11)
¿Qué elemento falta?
Respuesta: Nitrógeno (N), con número atómico 7.
Explicación: La secuencia aumenta en 2 unidades en cada paso.
3. Un científico ha descubierto un nuevo elemento con las siguientes propiedades:
• Tiene más protones que el oxígeno pero menos que el sodio.
• Se encuentra en el grupo 15 de la tabla periódica.
• Su nombre comienza con la letra «N».
¿De qué elemento se trata?
Respuesta: Nitrógeno (N), con número atómico 7.
Indicadores
Reconoce las nociones básicas y la teoría relacionada con el átomo, partículas subatómicas, número atómico, número másico, isótopos, masa atómica promedio, mediante la participación en las actividades orales y escritas planteadas por la persona docente.
Distingue de acuerdo con el concepto de átomo y sus partes, las diferentes características que presentan los elementos que nos rodean, mediante la participación en las actividades orales y escritas planteadas por la persona docente.