Planeamiento Química 10° Eje temático 1 temas 13, 14 y 15 (2025)
Instrucciones:
• Los bloques sombreados en color gris se pueden ocultar en la impresión final.
• Para ello haga clic sobre cada uno de los bloques que desea ocultar.
• Para encenderlo nuevamente, pulse el bloque otra vez.
• Solamente los bloques encendidos serán impresos.
• Pulse el botón «Imprimir» cuando se encuentre listo.
• Para un mayor aprovechamiento del espacio, recomendamos eliminar los márgenes al imprimir.
¿Cómo guardar PDF?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo, cambie el destino de la impresión:
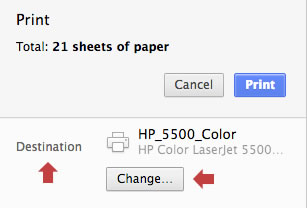
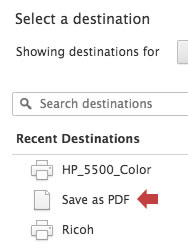
En las opciones, seleccione «Guardar como PDF»:
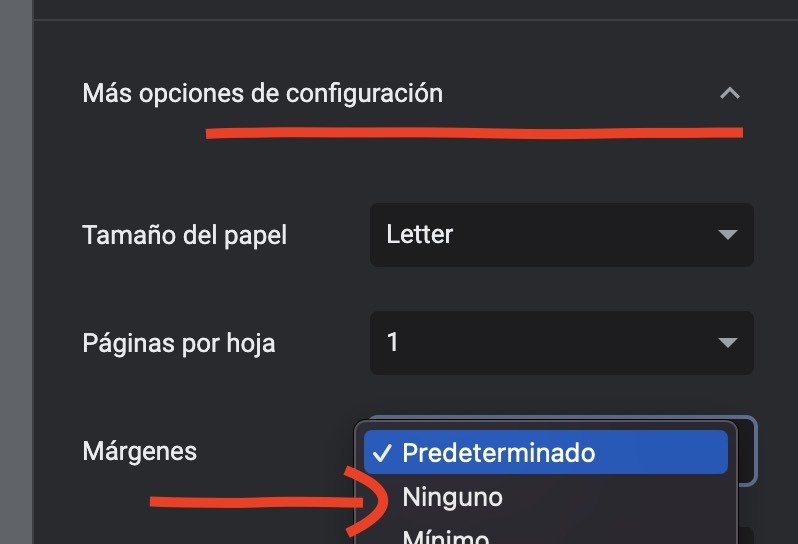
Para aprovechar todo el espacio de su hoja, recomendamos desactivar los márgenes:
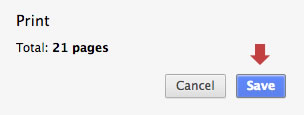
Por último pulse el botón «Guardar»:
¿Cómo imprimir en color?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo de la impresión siga las siguientes instrucciones:
Si desea imprimir el planeamiento a color, asegúrese de activar la opción «Color»:
En la sección «Más configuraciones»:
Active la opción «Gráficos de fondo»:

Finalmente pulse el botón «Imprimir»:
Curso lectivo: 2025
Periodicidad:
Competencias generales
Ciudadanía responsable y solidaria ( X )
Para la vida ( )
Para la empleabilidad digna ( )
Tema: Organización de los átomos / Configuración electrónica, electrón diferenciante y electrones de valencia / Efecto de las propiedades periódicas en la materia que nos rodea
Criterio de evaluación
Explicar mediante procesos gráficos la organización de los átomos en sus diferentes niveles, grupos, familias y capas.
Practicar gráficamente las configuraciones electrónicas bajo el sistema nlx reconociendo el electrón diferenciante y de valencia, por flechas, de acuerdo al comportamiento individual de cada elemento y sus posibles anomalías, así como la representación de compuestos por medio de las estructuras de Lewis.
Valorar la importancia del efecto positivo o negativo de las propiedades periódicas en nuestras acciones hacia la materia que nos rodea.
Estrategias de mediación
Focalización
El docente plantea la siguiente pregunta: «Si la tabla periódica es como una familia, ¿cómo se organizan sus miembros?» Los estudiantes responden en una lluvia de ideas.
El docente entrega tarjetas con pistas sobre elementos químicos por ejemplo:
• Tiene dos niveles de energía.
• Pertenece a los metales alcalinotérreos.
• Su símbolo químico es Be.
Los estudiantes deben identificar el elemento en la Tabla periódica y nivel de energía al que pertenecen. Justifican su elección.
El docente introduce los siguientes conceptos: grupos, períodos, niveles de energía y capas electrónicas. Los estudiantes crean un mapa mental donde organizan los conceptos,
Los estudiantes realizan la entrada de tema de la página 13 y se valora la tabla periódica como una forma de organizar los elementos.
Por medio de una focalización, Se les presenta a los estudiantes una imagen relacionada con los orbitales para que de la misma conteste: ¿Cómo es la simetría de la imagen (orbitales) que se encuentra al lado de cada letra s, p, d, f? ¿Cuál es la cantidad máxima de electrones que puede tener cada orbital? ¿Cuál orbital es más grande?
El docente inicia con la siguiente pregunta: «¿Cómo sabemos cuántos electrones tiene un átomo y cómo se organizan?» Los estudiantes responden en una lluvia de ideas.
Se entregan tarjetas con símbolos de elementos y los estudiantes deben ubicarlos en la tabla periódica e identificar su número de electrones.
El docente plantea la siguiente pregunta: «¿Por qué algunos elementos son más reactivos que otros?» y se analizan ejemplos como los gases nobles y los metales alcalinos. Los estudiantes contestan mediante una lluvia de ideas.
Los estudiantes realizan las actividades de entrada de tema de la página 126 y con la guía del docente comentan sus respuestas.
El docente inicia con la pregunta: «¿Cómo influye la ubicación de un elemento en la tabla periódica en su uso en la vida diaria?» Los estudiantes responden en una lluvia de ideas.
El docente les presenta imágenes de objetos cotidianos (pilas, termómetros, utensilios de cocina) y los estudiantes deben inferir qué propiedad periódica permite su uso.
Exploración
Los estudiantes elaboran un mapa conceptual que relacione capas electrónicas y subcapas (s, p, d, f), destacando cuántos electrones pueden contener para ello revisan el contenido de la página 105 del libro. Comparten el trabajo con los compañeros.
Los estudiantes elaboran una infografía digital o en cartulina explicando:
• Cómo los niveles de energía determinan los períodos.
• La cantidad de electrones que caben en cada nivel.
• Ejemplos de elementos en cada período.
Utilizan la información de la página 106 del libro. Luego, los estudiantes presentan la infografía al grupo y se discuten las tendencias periódicas relacionadas con los niveles de energía.
Cada estudiante diseña una infografía digital o en cartulina explicando las características de los grupos A y B de la tabla periódica. En una puesta en común comparten sus trabajos.
Los estudiantes crean un diagrama de Ishikawa para analizar cómo la ubicación de un elemento en una familia determina sus propiedades.
Ejemplo:
Causa: Ubicación en la familia de los metales alcalinos.
Efectos: Alta reactividad, baja densidad, tendencia a perder un electrón.
Comparten sus conclusiones con los compañeros.
Los estudiantes distribuidos en subgrupos se les asigna una familia química, cada grupo la investiga y expone su importancia en la naturaleza, la industria o la tecnología.
Se deben incluir ejemplos concretos, como el uso del helio en globos o el litio en baterías.
Los estudiantes elaboran un mapa mental que relacione el concepto de electrones, niveles de energía, orbitales y valencia. Comparten los resultados con los compañeros.
Los estudiantes realizan con la guía del docente una lectura comentada sobre la configuración electrónica: electrón diferenciante y electrones de valencia de las páginas 117 -123 y van construyendo un mapa conceptual de forma colectiva.
Los estudiantes realizan la lectura de las páginas 127 hasta la 129 del libro y crean un mapa mental donde organicen conceptos clave como radio atómico, electronegatividad, energía de ionización, afinidad electrónica y su relación con los grupos y períodos.
Reflexión y contrastación
Los estudiantes elaboran modelos físicos del átomo utilizando plastilina o materiales reciclados, representando:
• Capas electrónicas (K, L, M, N, etc.).
• Subcapas (s, p, d, f).
Cada grupo presenta su modelo y explica cómo se distribuyen los electrones en las capas y subcapas según el número atómico del elemento elegido.
Los estudiantes elaboran un cuadro comparativo donde analizan las diferencias entre períodos y niveles de energía, resaltando, por ejemplo:
| Característica | Niveles de energía | Períodos en la tabla periódica |
|---|---|---|
| ¿Dónde se encuentran? | Dentro del átomo | En la tabla periódica |
| ¿Qué indican? | Cantidad de capas electrónicas | Número de niveles de energía ocupados |
| Ejemplo de elementos | Sodio (Na): 3 niveles | Período 3: Na, Mg, Al… |
El docente divide a la clase en dos grupos para que debatan sobre la importancia de los grupos A y B, cada grupo se documenta sobre sus características y su importancia, por ejemplo: Un equipo argumenta que los elementos del Grupo A son más importantes para la vida, y el otro defiende que los elementos del Grupo B tienen más impacto en la industria.
Cada grupo usa ejemplos científicos y aplicaciones tecnológicas.
Los estudiantes realizan las Actividades de las páginas 108, 111,112 y 113 del libro. Comentan los resultados con los compañeros.
Los estudiantes realizan una actividad exploratoria y para ello realizarán:
Se organizan en grupos de 4 personas (estrictamente).14 globos. (1 de color azul, 2 de color rojo, 4 de color verde y 7 de color turquesa) si no consigue el color solicitado, solo asegúrese que la cantidad que se necesita sea del mismo color.
Realizan con el globo azul el orbital s. Con el globo rojo el orbital p.Con los 4 globos verdes el orbital d. Por ultimo realizo con los 7 globos turquesa el orbital f.
Lo muestran a la clase y comentan a detalle cómo armó cada orbital.
Contesto: ¿Qué es un orbital?
El docente contrasta lo que han realizado y lo explica ampliamente con la finalidad de que se comprenda lo que se aplicó.
El docente les plantea la siguiente pregunta: «¿Cuáles propiedades periódicas hacen que algunos metales sean más contaminantes que otros?» y los estudiantes analizan casos como el mercurio y el plomo.
Aplicación
Los estudiantes realizan la Evaluación de las páginas 114 y 115 del libro.
Se asignan familias y grupos a cada estudiante, y entre todos crean un gran mural de la tabla periódica con información visual sobre la distribución electrónica.
Los estudiantes realizan las Actividades de las páginas 120, 121 y 124. Comentan el resultado con los compañeros.
Los estudiantes organizan la información en un mapa conceptual, mostrando cómo los electrones determinan la formación de compuestos.
Los estudiantes elaboran un diagrama de Ishikawa sobre cómo las propiedades periódicas influyen en el daño ambiental de ciertos elementos químicos.
Los estudiantes en subgrupos elaboran un cuadro comparativo donde los estudiantes relacionan cada propiedad periódica con un efecto positivo y negativo. Comparte los resultados.
Por ejemplo:
| Propiedad Periódica | Definición | Ejemplo de Impacto Positivo | Ejemplo de Impacto Negativo |
|---|
| Radio Atómico | Tamaño del átomo, que aumenta en un grupo y disminuye en un período. | Los metales alcalinos, con radios atómicos grandes, son muy reactivos y útiles en baterías de litio. | Los elementos con radios grandes, como el cesio, pueden ser demasiado reactivos y peligrosos en contacto con el agua. |
| Electrone-gatividad | Capacidad de un átomo para atraer electrones en un enlace químico. | El flúor, altamente electronegativo, es esencial en pastas dentales para prevenir caries. | Elementos muy electronegativos, como el cloro, pueden ser tóxicos en altas concentraciones (ej. gas cloro). |
| Energía de Ionización | Energía necesaria para remover un electrón de un átomo neutro. | Elementos con alta energía de ionización, como los gases nobles, son estables y útiles en iluminación (neón). | Los metales con baja energía de ionización, como el sodio, reaccionan explosivamente con el agua. |
| Afinidad Electrónica | Energía liberada cuando un átomo gana un electrón. | Los halógenos tienen alta afinidad electrónica, lo que permite la formación de sales esenciales como el cloruro de sodio (sal común). | El oxígeno, al atraer electrones, contribuye a la corrosión de metales, dañando estructuras y vehículos. |
| Carácter Metálico | Tendencia de un elemento a perder electrones y comportarse como metal. | Metales como el cobre y la plata son excelentes conductores eléctricos y fundamentales en la tecnología. | Metales reactivos como el mercurio pueden ser tóxicos y contaminar el agua y los alimentos. |
Los estudiantes realizan las Actividades de la página 130 y comentan los resultados con los compañeros.
Indicadores
Explicar mediante procesos gráficos la organización de los átomos en sus diferentes niveles, grupos, familias y capas.
Practica gráficamente las configuraciones electrónicas bajo el sistema nlx reconociendo el electrón diferenciante y de valencia, por flechas, de acuerdo al comportamiento individual de cada elemento y sus posibles anomalías, así como la representación de compuestos por medio de las estructuras de Lewis, mediante las actividades didácticas propuestas.
Valora la importancia del efecto positivo o negativo de las propiedades periódicas en nuestras acciones hacia la materia que nos rodea, mediante las actividades didácticas propuestas.