Planeamiento Química 10° Eje temático tema 1, 2 y 3 (2025)
Instrucciones:
• Los bloques sombreados en color gris se pueden ocultar en la impresión final.
• Para ello haga clic sobre cada uno de los bloques que desea ocultar.
• Para encenderlo nuevamente, pulse el bloque otra vez.
• Solamente los bloques encendidos serán impresos.
• Pulse el botón «Imprimir» cuando se encuentre listo.
• Para un mayor aprovechamiento del espacio, recomendamos eliminar los márgenes al imprimir.
¿Cómo guardar PDF?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo, cambie el destino de la impresión:
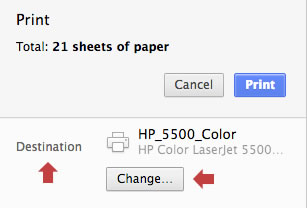
En las opciones, seleccione «Guardar como PDF»:
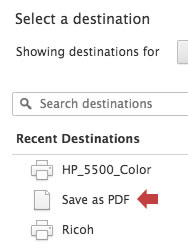
Para aprovechar todo el espacio de su hoja, recomendamos desactivar los márgenes:
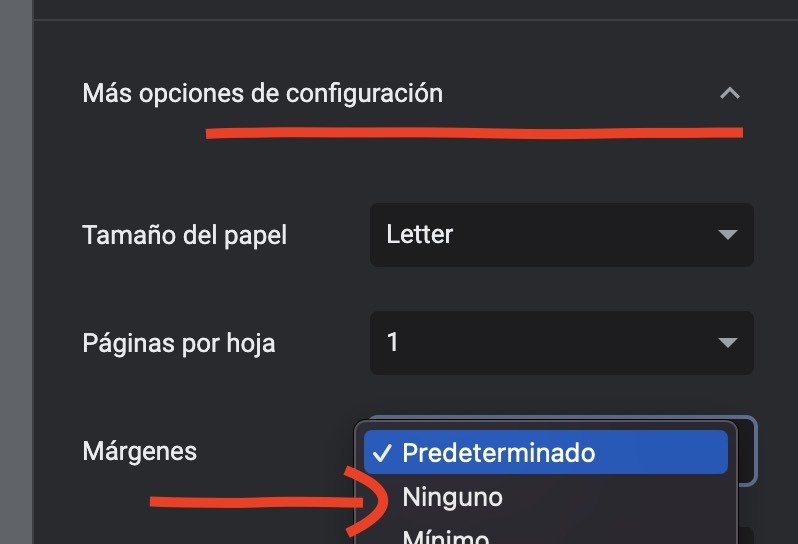
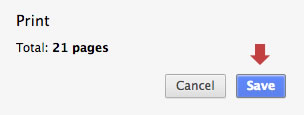
Por último pulse el botón «Guardar»:
¿Cómo imprimir en color?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo de la impresión siga las siguientes instrucciones:
Si desea imprimir el planeamiento a color, asegúrese de activar la opción «Color»:
En la sección «Más configuraciones»:
Active la opción «Gráficos de fondo»:

Finalmente pulse el botón «Imprimir»:
Curso lectivo: 2025
Periodicidad:
Competencias generales
Ciudadanía responsable y solidaria ( )
Para la vida ( x )
Para la empleabilidad digna ( )
Tema 1: Características de un enlace químico, representación de fórmulas: empírica, molecular y estructural. Tema 2: Compuestos iónicos, covalentes y presentación de Lewis. Tema 3: Importancia de los compuestos iónicos y los covalentes en interacción y aplicación con la vida
Criterio de evaluación
Describir las características que posee un enlace químico, así como la representación de las diferentes fórmulas, tales como la empírica, la molecular y la estructural.
Diferenciar los compuestos iónicos de los covalentes (polares, no polares, coordinados, simples, dobles, triples) incluyendo las representaciones de Lewis, sus ángulos y geometría molecular e hibridación.
Discriminar la importancia de los compuestos iónicos, covalentes (polares, no polares, coordinados, simples, dobles y triples) en los procesos de interacción y aplicación con la vida.
Estrategias de mediación
Focalización
Para estudiar las características de un enlace químico, representación de fórmulas: empírica, molecular y estructural observan y contestan, de acuerdo a la imagen correspondiente al ácido láctico:
1. ¿Cuál es el nombre de los átomos que participan en el compuesto que observo en la imagen?
2. Cuál es el número total de átomos que participan en la formación de la molécula?
3. ¿Cómo son los enlaces que unen a los átomos en la molécula?
4. Según los círculos de color rojo, negro y blanco que observo en la imagen ¿Cuáles elementos creo que representa cada color, según la molécula del ácido acético?
El docente plantea la pregunta: ¿Qué tienen en común las sustancias que usamos a diario como la sal, el azúcar y el alcohol?
El estudiante identifica ejemplos cotidianos y establece diferencias iniciales
El docente entrega muestras de etiquetas de productos (cloruro de sodio, etanol, CO₂, agua oxigenada).
El estudiante identifica fórmulas químicas y plantea hipótesis sobre el tipo de enlace.
El docente presenta un video breve sobre enlaces iónicos y covalentes en la naturaleza: Tipos de Enlaces Químicos. Iónico, Covalente y Metálico.
El estudiante responde a preguntas clave para reconocer conceptos previos.
El docente presenta un video breve sobre enlaces iónicos y covalentes en la naturaleza: ¿Qué son los enlaces químicos? Tipos de enlaces: Iónico, Covalente. El estudiante responde a preguntas clave para reconocer conceptos previos.
Algunas preguntas que se pueden plantear de acuerdo al contexto del grupo son las siguientes:
• ¿Qué es un enlace químico según el video?
• ¿Cómo se forma un enlace iónico? ¿Qué elementos tienden a participar en este tipo de enlace?
• ¿Qué sucede con los electrones en un enlace iónico?
• ¿Cuál es la diferencia principal entre un enlace iónico y un enlace covalente?
• ¿Qué tipo de enlace implica el “compartir” de electrones?
• ¿Qué ejemplo se menciona en el video para representar un enlace iónico?
• ¿Qué ejemplo se menciona para representar un enlace covalente?
• ¿Qué tipo de enlace se esperaría entre un metal y un no metal? ¿Y entre dos no metales?
• ¿Qué representa la diferencia de electronegatividad entre los átomos en la formación del tipo de enlace?
• ¿Qué aspecto visual del video te ayudó más a entender la diferencia entre los dos tipos de enlaces?
El docente lanza un reto verbal:Si solo observas una fórmula, ¿cómo sabrías qué tipo de compuesto es? El estudiante propone ideas con base en su conocimiento previo.
El docente organiza tarjetas de conceptos clave como: ión, electronegatividad, electrón compartido, electrón transferido, metal, no metal, enlace iónico, enlace covalente, compuesto, fórmula molecular, estructura de Lewis.
El docente entrega la tarjeta «ión» a un estudiante y le pide que la coloque en la pizarra.
El estudiante debe escribir una definición breve al lado (puede pedir apoyo al grupo).
Otro estudiante recibe la tarjeta «electrón transferido» y la coloca conectada a “ión”, explicando por qué se relacionan y así sucesivamente.
El docente plantea la pregunta inicial: ¿Por qué los átomos no se quedan solos?
El estudiante, en parejas, elabora una hipótesis sobre qué los mantiene unidos y la escribe en un papelógrafo.
El docente proyecta una tabla periódica y pregunta: ¿cómo se relaciona la posición de un elemento con su capacidad para formar enlaces?
El estudiante reflexiona y comparte sus ideas en plenario.
El docente presenta ejemplos de compuestos sencillos (H₂O, CH₄, NH₃, CO₂, NaCl).
El estudiante construye los modelos con plastilina, usando palillos como enlaces, e indica si son enlaces simples, dobles o triples.
Para el tema de compuestos iónicos, covalentes y presentación de Lewis,
los estudiantes inician su aprendizaje a través de una focalización con una serie de preguntas y una imagen donde se conteste:
-Cuando le echo azúcar al agua, ¿desaparece el azúcar? ¿Por qué sucede? ¿Qué mantiene unidos a los átomos de ese nuevo compuesto?
-¿A qué se debe que existan varios enlaces químicos?
-¿Por qué son tan importantes los electrones de valencia o números de oxidación?
En los enlaces químicos ¿cómo puedo asociarlos con la vida cotidiana?
Además, el docente puede plantear las siguientes preguntas:
• ¿El azúcar cambia su composición química al disolverse? ¿Por qué sí o por qué no?
• ¿Qué diferencia hay entre disolver y reaccionar químicamente?
• ¿Qué te dice esto sobre la estabilidad de las sustancias en nuestro entorno?
• ¿Cómo se relacionan estas interacciones con lo que ocurre en nuestro cuerpo cuando consumimos azúcar?
• ¿Creen que las sustancias iónicas y covalentes se comportan igual en agua? ¿Por qué?
• ¿En qué otros contextos de tu vida diaria ves cómo se combinan sustancias o se forman mezclas?
• ¿Podrías pensar en algún alimento, medicamento o producto que actúe diferente según el tipo de enlace que contiene?
• ¿Cómo creen que los científicos pueden predecir las propiedades de una sustancia solo con su fórmula química?
El docente formula preguntas clave:
• ¿Qué relación existe entre la alimentación y los compuestos químicos?
• ¿Cuál crees que es uno de los compuestos covalentes más comunes en nuestra dieta?
• ¿Qué características crees que comparten los compuestos iónicos y covalentes?
• ¿Cómo actúan en nuestro cuerpo estas sustancias?
El estudiante, en parejas, contesta en su cuaderno y discute con su compañero antes del plenario.
Exploración
Los estudiantes revisan el contenido de las páginas 139-140 del libro, sobre el Enlace químico y el cálculo de fórmulas empíricas, molecular y estructural. Organizan la información y la representan mediante un mapa semántico. Comparten los resultados con los compañeros.
El docente entrega esferas (átomos) y palillos (enlaces) para representar enlaces simples, dobles y triples. El estudiante, en grupos, construye modelos de H₂, O₂, CO₂ y CH₄, identificando el tipo de enlace.
El docente entrega tarjetas con fórmulas (ej: H₂O, CH₄, C₂H₆, C₆H₁₂O₆, NaCl, CaCl₂).
El estudiante clasifica las tarjetas en dos columnas: empíricas o moleculares, y justifica su decisión.
Los estudiantes organizados en parejas revisan el contenido de las páginas 145-150 del libro, Subrayan las información más importante la organizan en un lapbook. Comparten el trabajo con los compañeros.
El docente explica cómo determinar la estructura de Lewis (electrones de valencia, pares libres y enlaces).
El estudiante, individualmente, representa estructuras de:
• H₂O
• NH₃
• CH₄
• CO₂
• O₂
• Cl₂
• HCN
• NaCl
Por medio de la explicación de la persona docente se interiorizan los diferentes conceptos relacionados con los Compuestos iónicos de los covalentes (polares, no polares, coordinados, simples, dobles, triples).
El docente guía la observación de la tabla en la página 152 (tipo de geometría según pares de electrones enlazantes y no enlazantes).
El estudiante, en grupos, responde:
• ¿Qué patrón observas entre el número de pares de electrones y la geometría?
• ¿Qué geometría tiene una molécula con 2 enlaces y 0 pares libres?
• ¿Qué geometría esperas si hay 3 enlaces y 1 par libre?
El docente entrega plastilina y palillos (o kits moleculares).
El estudiante, con base en la tabla RPECV, construye modelos de:
• Lineal (sp): BeCl₂, CO₂
• Trigonal plana (sp²): BF₃, C₂H₄
• Tetraédrica (sp³): CH₄, NH₃, H₂O
Cada grupo etiqueta la geometría y tipo de hibridación.
El docente guía una lectura comentada de la tabla de compuestos (nombre, fórmula y uso) de la página 157 del libro.
El estudiante, de forma individual, elige 2 compuestos iónicos y 2 covalentes de la tabla y completa una ficha como esta:

El docente entrega una silueta del cuerpo humano.
El estudiante, en grupos, ubica en la silueta etiquetas con compuestos y sus funciones:
• Na⁺ y K⁺ → transmisión nerviosa
• Ca²⁺ → contracción muscular y huesos
• H₂O → regulación térmica
• C₆H₁₂O₆ → fuente de energía
El docente asigna a cada grupo un sector industrial (alimentaria, farmacéutica, limpieza).
El estudiante investiga y expone compuestos iónicos o covalentes usados en ese sector, su fórmula y su función. Exponen los resultados a los compañeros.
Reflexión y contrastación
El docente explica las diferencias entre fórmula empírica, molecular y estructural.
El estudiante elige un compuesto (como H₂O₂ o C₂H₆O) y representa las tres fórmulas en su cuaderno, incluyendo el nombre del compuesto.
El docente guía a los estudiantes en una simulación interactiva (por ejemplo, con el recurso de PhET).
El estudiante construye moléculas sencillas, observa sus estructuras y toma notas de patrones de enlace.
Los estudiantes realizan las Actividades de las páginas 141 del libro y comparan los resultados con los compañeros.
El docente plantea la pregunta guía: ¿Por qué ciertos compuestos se disuelven fácilmente en agua y otros no?
El estudiante compara propiedades de compuestos iónicos y covalentes y redacta conclusiones.
El docente presenta casos cotidianos (como el uso del CO₂ en bebidas o la sal en el cuerpo humano).
El estudiante analiza la importancia del tipo de enlace para su función.
El docente guía un debate científico: ¿Es más útil un compuesto covalente que uno iónico?
El estudiante, con evidencia, argumenta su posición.
Con la finalidad de que se interiorice se le solicita a los estudiantes que refuercen el tema en la casa mediante el link propuesto en la sección de enlaces.
Los estudiantes realizan las Actividades de la página 151 del libro. Revisan los resultados con los compañeros.
El docente plantea una tabla incompleta, en la pizarra, con columnas: Molécula – Geometría – Hibridación – Ángulo aproximado
El estudiante la completa con base en las páginas del libro. Ejemplo:

El docente plantea situaciones como:
• “Tengo una molécula con ángulo de 120° y tres regiones de densidad electrónica, ¿qué hibridación es?”
• “Una molécula tiene una forma piramidal y un par libre, ¿cuál es su geometría y hibridación?”
El estudiante, en parejas, razona las respuestas usando la tabla del libro.
El docente da tarjetas con fórmulas: CH₄, CO₂, NH₃, H₂O, C₂H₂, C₂H₄.El estudiante describe oralmente o por escrito:
• Su geometría
• Su tipo de enlace (simple, doble, triple)
• Su hibridación
• El ángulo entre enlaces
El docente plantea preguntas como:
• ¿Por qué el agua no es lineal si solo tiene dos enlaces?
• ¿Qué determina el ángulo entre enlaces?
• ¿Por qué la hibridación sp da lugar a geometría lineal?
El estudiante, en grupo, discute y defiende su respuesta con base en la información del libro.
El docente propone crear una infografía digital o física sobre un compuesto (a elegir) que incluya:
• Tipo de enlace
• Estructura de Lewis o fórmula
• Usos
• Importancia para el cuerpo o la industria
Exponen sus trabajos a los compañeros.
Aplicación
El docente entrega ejercicios donde se debe deducir la fórmula empírica a partir de masas de elementos. El estudiante aplica cálculos y justifica la fórmula resultante.
Por ejemplo:
1- Un compuesto contiene un 40% de carbono (C) y un 60% de oxígeno (O) en masa. Determine la fórmula empírica.
2- Un compuesto tiene la siguiente composición: 27.3% de carbono (C) y 72.7% de oxígeno (O). Determine la fórmula empírica.
3- La composición porcentual de un compuesto es: 80.0% de carbono (C) y 20.0% de hidrógeno (H)
Determine la fórmula empírica.
4-Un compuesto orgánico contiene: 52.2% de carbono (C), 13.0% de hidrógeno (H) y 34.8% de oxígeno (O). Determine la fórmula empírica.
5-El análisis de un compuesto dio los siguientes resultados: 21.6% de sodio (Na), 33.1% de cloro (Cl) y 45.3% de oxígeno (O). Determine la fórmula empírica.
El docente propone crear una historieta donde dos átomos se conocen y se enlazan.
El estudiante narra la historia desde la perspectiva de los átomos, ilustrando el tipo de enlace y mostrando sus fórmulas empírica, molecular y estructural.
Los estudiantes realizan los ejercicios de la Evaluación de las páginas 142-143 del libro.
El docente propone el análisis de errores comunes al representar estructuras de Lewis. El estudiante corrige errores y explica por qué son incorrectos. Por ejemplo:
Caso #1 Superar el octeto
H:Ö:–H → 10 electrones alrededor del oxígeno
Caso #2 Enlace incorrecto en H₂
H–H– → con un electrón libre en cada H
Caso # 3 Falta de pares libres en el oxígeno (ej: O₂)
O=O
Caso # 4: Valencias incorrectas en el carbono (ej: CH₄)
C con solo dos enlaces H
El docente asigna una investigación: identificar compuestos comunes en productos de limpieza, alimentos o medicamentos.
El estudiante clasifica y explica sus estructuras y tipo de enlace.
El docente organiza una feria científica con stands temáticos (ej: “el poder del ión”, “moléculas que curan”).
El estudiante representa un compuesto e ilustra su importancia.
El docente plantea problemas reales sobre contaminación del agua por compuestos iónicos.
El estudiante elaboran carteles en los que proponen soluciones químicas razonadas. Exponen los trabajos a sus compañeros.
El docente propone una actividad creativa: crear un personaje animado que represente un compuesto (nombre, estructura, poderes, debilidades). El estudiante expone su personaje justificando su comportamiento químico.
El docente plantea un estudio de caso: análisis de medicamentos como el paracetamol.
El estudiante analiza el tipo de enlace y su función terapéutica.
Indicadores
Cita las características que posee un enlace químico, así como la representación de las diferentes fórmulas, tales como la empírica, la molecular y la estructural para un contexto establecido, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Encuentra similitudes y diferencias entre las características que posee un enlace químico, así como la representación de las diferentes fórmulas, tales como la empírica, la molecular y la estructural y los patrones detectados como datos, hechos o acciones en diversos contextos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Compara las características que posee un enlace químico, así como la representación de las diferentes fórmulas, tales como la empírica, la molecular y la estructural con patrones detectados entre datos, hechos o acciones en diversos contextos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Menciona aspectos generales de las características que posee un enlace químico, así como la representación de las diferentes fórmulas, tales como la empírica, la molecular y la estructural, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Resalta aspectos específicos de las características que posee un enlace químico, así como la representación de las diferentes fórmulas, tales como la empírica, la molecular y la estructural, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Describe de manera general las características que posee un enlace químico, así como la representación de las diferentes fórmulas, tales como la empírica, la molecular y la estructural, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Menciona las causas y efectos que originan los compuestos iónicos de los covalentes (polares, no polares, coordinados, simples, dobles, triples) incluyendo las representaciones de Lewis, sus ángulos y geometría molecular e hibridación en contextos complejos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Resalta aspectos específicos de las causas y efectos que originan los compuestos iónicos de los covalentes (polares, no polares, coordinados, simples, dobles, triples) incluyendo las representaciones de Lewis, sus ángulos y geometría molecular e hibridación en contextos complejos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Describe los compuestos iónicos de los covalentes (polares, no polares, coordinados, simples, dobles, triples) incluyendo las representaciones de Lewis, sus ángulos y geometría molecular e hibridación, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Anota de forma general los pasos realizados para solucionar problemas de los compuestos iónicos, los covalentes (polares, no polares, coordinados, simples, dobles, triples) incluyendo las representaciones de Lewis, sus ángulos y geometría molecular e hibridación, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Relata los pasos realizados para solucionar problemas de los compuestos iónicos, los covalentes (polares, no polares, coordinados, simples, dobles, triples) incluyendo las representaciones de Lewis, sus ángulos y geometría molecular e hibridación, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Justifica los compuestos iónicos, los covalentes (polares, no polares, coordinados, simples, dobles, triples) incluyendo las representaciones de Lewis, sus ángulos y geometría molecular e hibridación, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Cita la importancia de los compuestos iónicos, covalentes (polares, no polares, coordinados, simples, dobles y triples) y metálicos en los procesos de interacción y aplicación con la vida, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Determina la importancia de los compuestos iónicos, covalentes (polares, no polares, coordinados, simples, dobles y triples) en los procesos de interacción y aplicación con la vida, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Destaca aspectos relevantes de la importancia de los compuestos iónicos, covalentes (polares, no polares, coordinados, simples, dobles y triples) en los procesos de interacción y aplicación con la vida, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Indica aspectos básicos de la importancia de los compuestos iónicos, covalentes (polares, no polares, coordinados, simples, dobles y triples) en los procesos de interacción y aplicación con la vida, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Comprende la importancia de los compuestos iónicos, covalentes (polares, no polares, coordinados, simples, dobles y triples) y metálicos en los procesos de interacción y aplicación con la vida, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Caracteriza de forma general la importancia de los compuestos iónicos, covalentes (polares, no polares, coordinados, simples, dobles y triples) y metálicos en los procesos de interacción y aplicación con la vida, mediante actividades didácticas orales y escritas asignadas por la persona docente.