Planeamiento Ciencias 8° Eje temático 2 tema 7 y 8 (2025)
Instrucciones:
• Los bloques sombreados en color gris se pueden ocultar en la impresión final.
• Para ello haga clic sobre cada uno de los bloques que desea ocultar.
• Para encenderlo nuevamente, pulse el bloque otra vez.
• Solamente los bloques encendidos serán impresos.
• Pulse el botón «Imprimir» cuando se encuentre listo.
• Para un mayor aprovechamiento del espacio, recomendamos eliminar los márgenes al imprimir.
¿Cómo guardar PDF?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo, cambie el destino de la impresión:
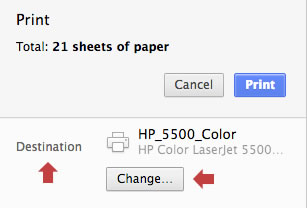
En las opciones, seleccione «Guardar como PDF»:
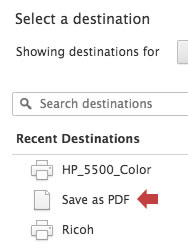
Para aprovechar todo el espacio de su hoja, recomendamos desactivar los márgenes:
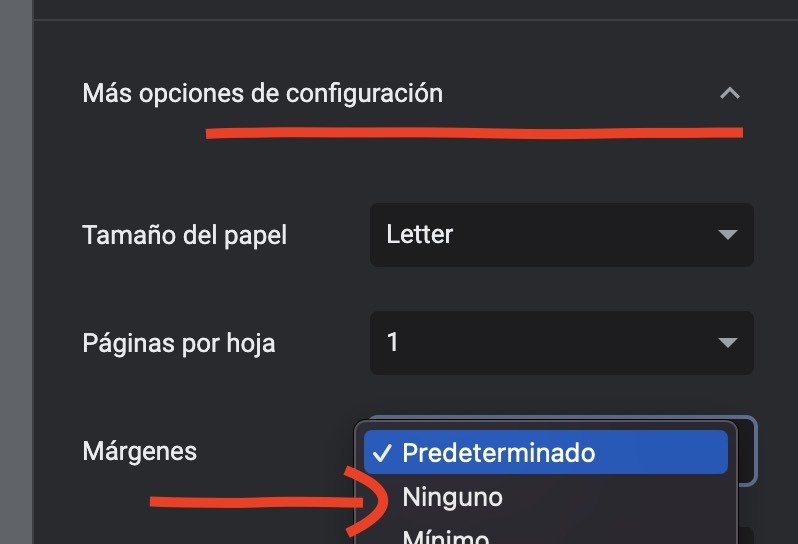
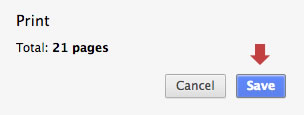
Por último pulse el botón «Guardar»:
¿Cómo imprimir en color?

Recomendamos utilizar el navegador Google Chrome.
Si no lo tiene instalado en su dispositivo puede descargarlo aquí.
El diálogo de impresión iniciará en cuanto cierre estas instrucciones.
En el cuadro de diálogo de la impresión siga las siguientes instrucciones:
Si desea imprimir el planeamiento a color, asegúrese de activar la opción «Color»:
En la sección «Más configuraciones»:
Active la opción «Gráficos de fondo»:

Finalmente pulse el botón «Imprimir»:
Curso lectivo: 2025
Periodicidad:
Competencias generales
Ciudadanía responsable y solidaria ( )
Para la vida ( x )
Para la empleabilidad digna ( )
Tema 7: El átomo / Tema 8: Número atómico y mágico
Criterio de evaluación
1. Describir la estructura y partículas fundamentales del átomo, como constituyente de los elementos químicos.
2. Aplicar los cálculos de número másico, número atómico y número de electrones, para el reconocimiento de elementos químico en la forma de átomos neutros, aniones, cationes e isótopos.
3. Valorar los avances científicos y tecnológicos que han permitido la comprensión del átomo, como componente fundamental de los materiales que utilizamos en la vida diaria.
Estrategias de mediación
Focalización
A partir de las actividades realizadas para comprender el uso sostenible de algunos elementos químicos, se plantean tres preguntas en la página # 120. ¿Además de los símbolos, cómo podemos diferenciar un elemento químico de otro, utilizando las Tablas Periódicas En plenaria se comparten y anotan las ideas.
El docente plantea la pregunta: “¿De qué creen que está hecha toda la materia que conocemos?” y anota las ideas en la pizarra.
El estudiante reflexiona y responde con base en sus conocimientos previos sobre la materia y la composición de los objetos.
Los estudiantes trabajan de forma colectiva la entrada de tema de la página 120 del libro. El docente les plantea, además, las siguientes preguntas:
• ¿Has escuchado antes la palabra “átomo”? ¿Dónde o en qué contexto?
• ¿Qué tan pequeño crees que es un átomo?
• ¿De qué crees que están hechas las cosas que vemos y tocamos?
• ¿Crees que todos los átomos son iguales? ¿Por qué sí o por qué no?
• ¿Para qué sirve conocer cómo es un átomo?
• ¿Conoces algún científico que haya estudiado los átomos?
• ¿Qué crees que sucede dentro de un átomo?
• ¿Qué relación crees que hay entre los átomos y los elementos químicos?
• ¿Crees que los átomos se pueden ver? ¿Cómo?
• ¿Cómo imaginas que es la estructura interna del átomo?
El docente plantea la pregunta: “¿De qué creen que está hecha toda la materia que conocemos?” y anota las ideas en la pizarra.
El estudiante reflexiona y responde con base en sus conocimientos previos sobre la materia y la composición de los objetos.
El docente presenta un breve video o animación sobre la historia del átomo y su representación a lo largo del tiempo, Los MODELOS ATÓMICOS: Demócrito, Dalton, Thomson, Rutherford, Bohr, Sommerfeld, Cuántico.
El estudiante observa el video, toma notas y comparte lo que más le llamó la atención en una lluvia de ideas.
Los estudiantes trabajan de forma colectiva la entrada de tema de la página 126 del libro. El docente les plantea, además, las siguientes preguntas:
• ¿Has visto antes un número junto al símbolo de un elemento químico? ¿Qué crees que significa?
• ¿Qué información crees que puede dar un número que aparece en la tabla periódica junto al nombre de un elemento?
• ¿Crees que todos los átomos de un mismo elemento tienen el mismo número de protones? ¿Por qué?
• ¿Qué partes del átomo crees que tienen masa?
• ¿Qué tan importantes crees que son los protones y los neutrones para “construir” un átomo?
• Si un átomo tiene más protones que otro, ¿serán iguales? ¿Por qué sí o por qué no?
• ¿Cuál crees que es la diferencia entre contar partículas y sumar su peso?
• ¿Crees que el número atómico puede ayudar a identificar un elemento?
• ¿Para qué te parece útil conocer cuántas partículas tiene un átomo?
• ¿Cómo crees que podríamos saber cuántas partículas hay en el núcleo de un átomo?
El docente presenta una imagen ampliada de la tabla periódica y señala el número atómico y el número másico de algunos elementos comunes, formulando preguntas orientadoras como: “¿Qué nos dice cada número?”
El estudiante observa, comparte sus ideas previas y anota sus hipótesis sobre el significado de los números.
El docente plantea una situación problemática: “¿Por qué un mismo elemento puede tener diferentes masas?” e introduce brevemente el concepto de isótopos.
El estudiante propone posibles respuestas y se prepara para indagar en el tema.
Exploración
Los estudiante leen el texto de la página 121 sobre las partículas fundamentales del átomo: protón, neutrón y electrón, con su ubicación y carga.
El estudiante subraya información clave y elabora un esquema con los datos de cada partícula.
Por medio del libro de texto Ciencias 8, páginas # 121-123 y con apoyo de recursos tecnológicos digitales, el estudiantado selecciona la información que considera relevante acerca de la definición de átomo mediante un mapa conceptual.
Además con información relacionada de las investigaciones y personas que contribuyeron a la comprensión del modelo atómico actual (Demócrito, Dalton, Thomson, Rutherford, Bohr, Schrödinger, entre otros. Al tomar en cuenta la información consultada, cada subgrupo compara los modelos propuestos con un cuadro comparativo y comunican sus conclusiones.
Posteriormente él o la docente puede realizar una presentación en Power Point para mostrar las diferentes concepciones acerca del átomo que tuvieron diferentes pensadores y científicos a lo largo de la historia hasta llegar al modelo actual del átomo.
En subgrupos, se facilitan lecturas con la descripción breve del modelo atómico de Bohr, que hace referencia a la presencia de un núcleo que contiene protones y neutrones y la existencia de órbitas con electrones.
El docente organiza una línea del tiempo en grupo sobre los modelos atómicos desde Dalton hasta el modelo actual, para lo cual revisan de forma colectiva el contenido de las páginas 122 y 123 del libro.
El estudiante investiga a un científico asignado, sintetiza su aporte e ilustra el modelo propuesto.
Los estudiantes leen el contenido de las página 127 hasta la 129 del libro y elaboran un lapbook extrayendo los conceptos. Con la guía del docente presentan su trabajo a los compañeros.
Contrastan cuando por medio del libro de texto Ciencias 8 páginas # 127-129 cada subgrupo consulta información referente a la definición de átomo neutro, ion, anión, catión y su relación con el cálculo de la cantidad de electrones.
También, consultan información vinculada a la definición de isótopo y su relación con el cálculo de la cantidad de neutrones. Posteriormente él o la docente resuelve algunos ejercicios en la pizarra para explicar dichos conceptos de forma práctica.
Reflexión y contrastación
El docente orienta una actividad de construcción de un modelo físico del átomo con materiales (cartulina, bolas de unicel, plastilina, etc.).
El estudiante representa las partículas fundamentales, las ubica correctamente y presenta su modelo a la clase.
Se entregan a cada subgrupo un elemento químico diferente, para que propongan cómo elaborar la representación del modelo atómico del litio, Carbono, Oxígeno, Sodio, Berilio entre otros, según la descripción de Bohr. Para realizar el modelo se indica a cada subgrupo la cantidad de neutrones, protones y electrones, que posee el elemento asignado.
El docente plantea la pregunta guía: “¿Por qué crees que el modelo del átomo ha cambiado a lo largo del tiempo?”
El estudiante reflexiona en su cuaderno y comparte su opinión con base en lo que aprendió sobre los aportes científicos.
El docente guía una comparación entre dos modelos atómicos (por ejemplo, el de Thomson y el de Bohr).
El estudiante elabora en su cuaderno un cuadro comparativo donde identifica diferencias, semejanzas y avances entre los modelos.
Los estudiantes realizan de forma individual las Actividades de la página 123. Comparten los resultados con los compañeros.
Los estudiantes realizan el Indago de la página 124 del libro y al finalizar socializan los resultados con los compañeros.
El docente orienta una actividad de laboratorio con modelos físicos (esferas de colores o diagramas) para representar átomos neutros, cationes y aniones.
El estudiante construye modelos, cuenta las partículas y explica los cambios según el tipo de ion.
Aplicación
El docente guía la elaboración de una historieta o cómic en la que el protagonista sea un átomo que cuenta su historia y evolución desde Dalton hasta hoy.
El estudiante diseña la historieta explicando, de forma creativa, las partículas del átomo y los modelos atómicos.
Se les solicita a los estudiantes realizar actividades de las páginas # 123, 125 y 151 y en subgrupos pueden señalar ¿de qué otra forma les gustaría aprender acerca de los modelos atómicos? ¿Cuáles actividades proponen para mejorar el conocimiento adquirido respecto al átomo? Se elige por consenso, alguna de las actividades para implementarla en la clase.
Los estudiantes realizan la Evaluación de la página 125 en la identifican los modelos atómicos con el nombre del científico que los propuso.
Exploran mediante una plenaria se analizan los datos específicos que nos brinda la Tabla Periódica, respecto al número atómico (Z = número de protones) y la masa atómica (A = protones + neutrones).
Cada estudiante analiza casos como el siguiente: “Si la masa atómica del Níquel equivale a 59 y su número atómico es 28 ¿Cómo podemos calcular el número de neutrones que tiene su núcleo?” Se plantean otros retos para reconocer diferentes elementos químicos a partir de los cálculos relacionados con el número atómico y masa atómica.
Se registran los resultados en cuadros.
Luego se les solicita a los estudiantes ¿qué realicen la relación que tiene la generación de corriente eléctrica, con los cationes y aniones? Se socializan y anotan las conclusiones.
Indicadores
Menciona el conocimiento relevante acerca de la estructura y partículas del átomo, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Resalta aspectos específicos del conocimiento relevante acerca de la estructura y partículas del átomo, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Describe el conocimiento relevante acerca de la estructura y partículas del átomo, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Enlista las ideas propuestas para la representación de los modelos atómicos. Elige las ideas propuestas para la representación de los modelos atómicos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Comprueba la pertinencia de las ideas propuestas para representación de los modelos atómicos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Especifica la representación de los modelos atómicos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Explora diversas fuentes de información para encontrar el número atómico y la masa atómica, en el reconocimiento de diferentes elementos químicos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Demuestra el proceso realizado para encontrar el número atómico y la masa atómica, en el reconocimiento de diferentes elementos químicos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Anota las características básicas para la expresión de elementos químicos en forma de átomos neutros, cationes, aniones e isótopos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Destaca aspectos relevantes para la expresión de elementos químicos en forma de átomos neutros, cationes, aniones e isótopos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Establece las características básicas para la expresión de elementos químicos en forma de átomos neutros, cationes, aniones e isótopos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Anota la importancia del quehacer científico, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Relata la importancia del quehacer científico, a partir de la comprensión del átomo, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Justifica la importancia del quehacer científico, a partir de la comprensión del átomo, para el desarrollo social, económico y ambiental de Costa Rica y otros países, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Esquematiza las ideas de que la materia está conformada por átomos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Describe por medio de representaciones, que la materia está conformada por átomos, mediante actividades didácticas orales y escritas asignadas por la persona docente.
Desarrolla por medio de expresiones artísticas, las ideas de que la materia está conformada por átomos, mediante actividades didácticas orales y escritas asignadas por la persona docente.